遺伝子治療
遺伝子治療がはじまり20年の年月が過ぎた。2007年の時点で、1300以上のプロトコールの元で臨床研究が実施されている。実施当初遺伝子治療は単一遺伝子疾患において異常遺伝子を修復するという試みから始まった。故障した遺伝子の変わりに正常な遺伝子を入れようと言う発想である。現時点では遺伝子治療が示す意味はもっと広義となり、疾患の治療を目的に、原因遺伝子ではないがその疾患に対してプラスとなる遺伝子を患者の体内に発現させることと考えられている。これは、多因子、多遺伝子疾患も対象に入ることを意味している。
遺伝子治療では遺伝子を体内の細胞に入れる必要があるが、実際に体内に入れるにはどうするのか。細胞に遺伝子を入れる道具をベクターというが、現在最も広く使われているベクターはウイルスベクターである。ウイルスは人間を含む動物に入り込み自分の遺伝子を動物の細胞に送り込み、細胞分裂を利用して自分の遺伝子も増やし、細胞外にでてまた他の細胞に移り住むという性質を持っている。ウイルスベクターの原理は、ウイルスの自己増殖能や病原性をコードする遺伝子を取り除き、発現させたい遺伝子を組み込み、それを体内に導入して発現させたい蛋白を作り出すというものである。
これまで米国で行われた遺伝子治療の結果としては当初期待された効果を上げることはできず、後述する多くの技術的問題に直面した。悪性腫瘍の場合、多くの対象例が他に治療法がない患者であったため、生命予後などから臨床成績が不良となったことが考えられるが、これまでの遺伝子導入技術では遺伝子導入効率、発現量、発現期間、特異的発現など様々な点で、実際の人間の体内で正常に発現しているレベルに届かないため、期待される治療効果が得られていないことが主因であろう。このことから現在の遺伝子治療研究は既存のベクターを用いた臨床的研究から、ベクターの基礎的研究が主流となり、研究の中心はベクターの性能向上に集中する方向へ移行してきた。
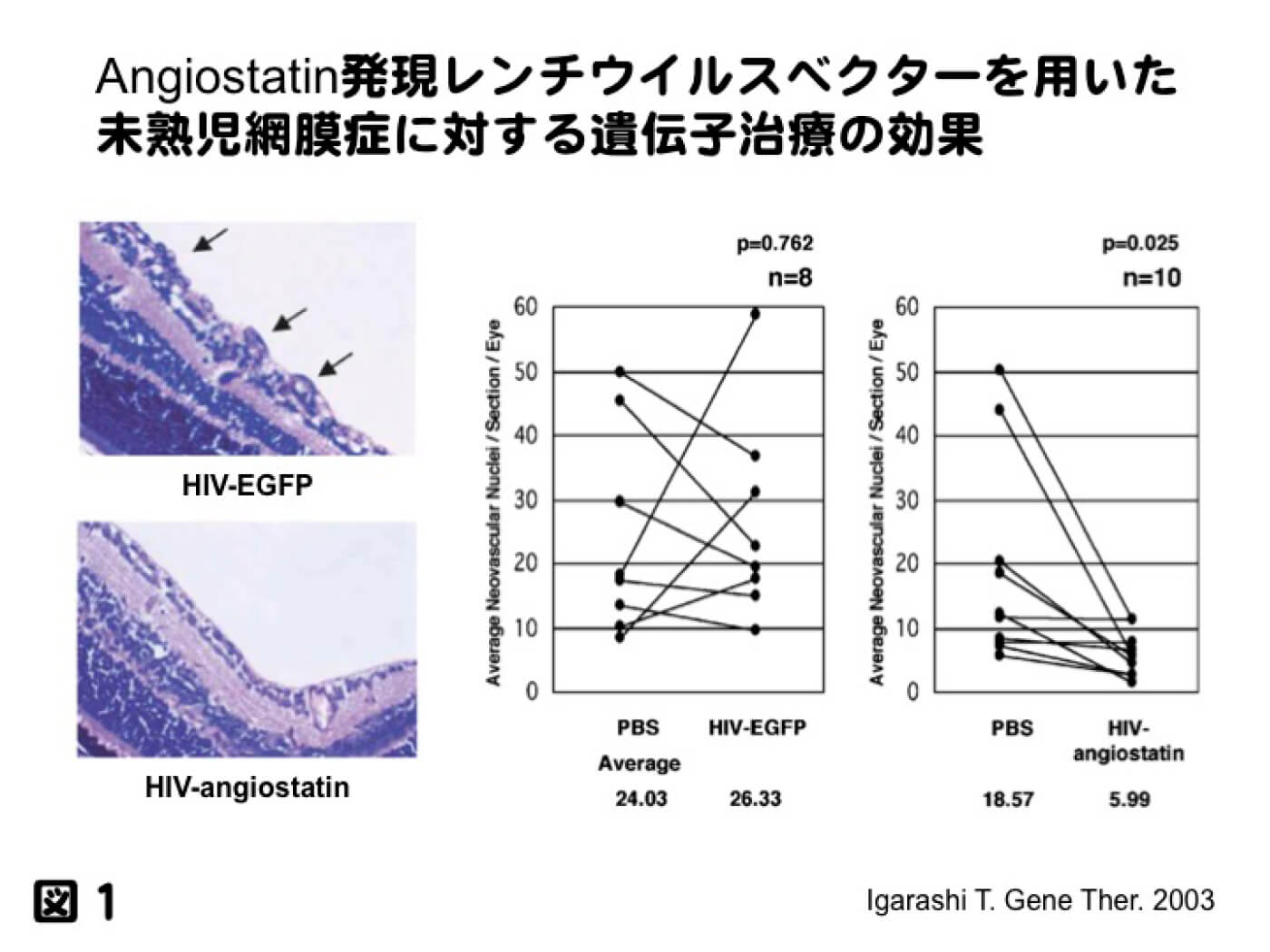
眼科分野でも様々なウイルベクターを用いた基礎実験が行われてきている。我々は当大学の分子遺伝学教室と共同研究を行うことにより、アデノウイルスベクター、アデノ随伴ウイルス(AAV)ベクター、レトロウイルスベクター、レンチウイルスベクターを用いて実験を展開してきた。これらのベクターにはそれぞれ利点欠点がある。アデノウイルスベクターは作成が比較的容易である反面、免疫原性の問題で長期の遺伝子発現を行うことができない。レトロウイルスベクターは染色体に組み込まれる事で長期発現が可能であるが、逆に癌抑制遺伝子への挿入などの危険性を含んでいる事と非分裂細胞への導入は不可能である。レンチウイルスベクターはレトロウイルスベクターの欠点である非分裂細胞への導入を可能としたが、代表的なレンチウイルスベクターはHIV-1を基に開発されたものであり、AIDSを発症する病原性が懸念される。ただし現在では、修飾遺伝子、制御遺伝子、LTR内のプロモーターも削除され、安全性が高まったことにより遺伝子組み換実験において、以前はP3レベルであったが現在はP2レベルでの実験が可能となっている。各ベクターの特性などについては、下記の総説にまとめてあるのでご一読願いたい(五十嵐勉ら. 遺伝子治療の基礎と眼疾患への応用. あたらしい眼科、19(9):1185-1196、2002)。この当時は、当教室でも、AAVベクターの遺伝子導入効率が低く、レンチウイルスベクターを用いた検討を行っていた。図1は、レンチウイルスベクターに抗新生血管抑制効果を示すアンギオスタチンを発現させ、未熟児網膜症モデルに対して新生血管抑制効果を示したものである(Igarashi T, et al. Gene therapy 10(3): 219-226, 2003)。
しかしながら、AAVベクターは細胞傷害性や病原性がないため安全性の点で優れたベクターであり、当教室では現在主にAAVベクターを用いて研究を行っている。AAVの不顕性感染は一般的で、成人の85%以上がAAVの抗体を持っている。野生型AAVは19番染色体の特定の領域に組み込まれることが知られており、これはベクターとして重要な長所として期待されたが、実際にはAAVのREP遺伝子を欠損した組み替えウイルスベクターではこの性質が失われていることが明らかにされている。また非分裂細胞にも遺伝子導入できるが、その場合は染色体に組み込まれるのではなくエピゾーマルに留まると言われているため安全性が高いと言える。
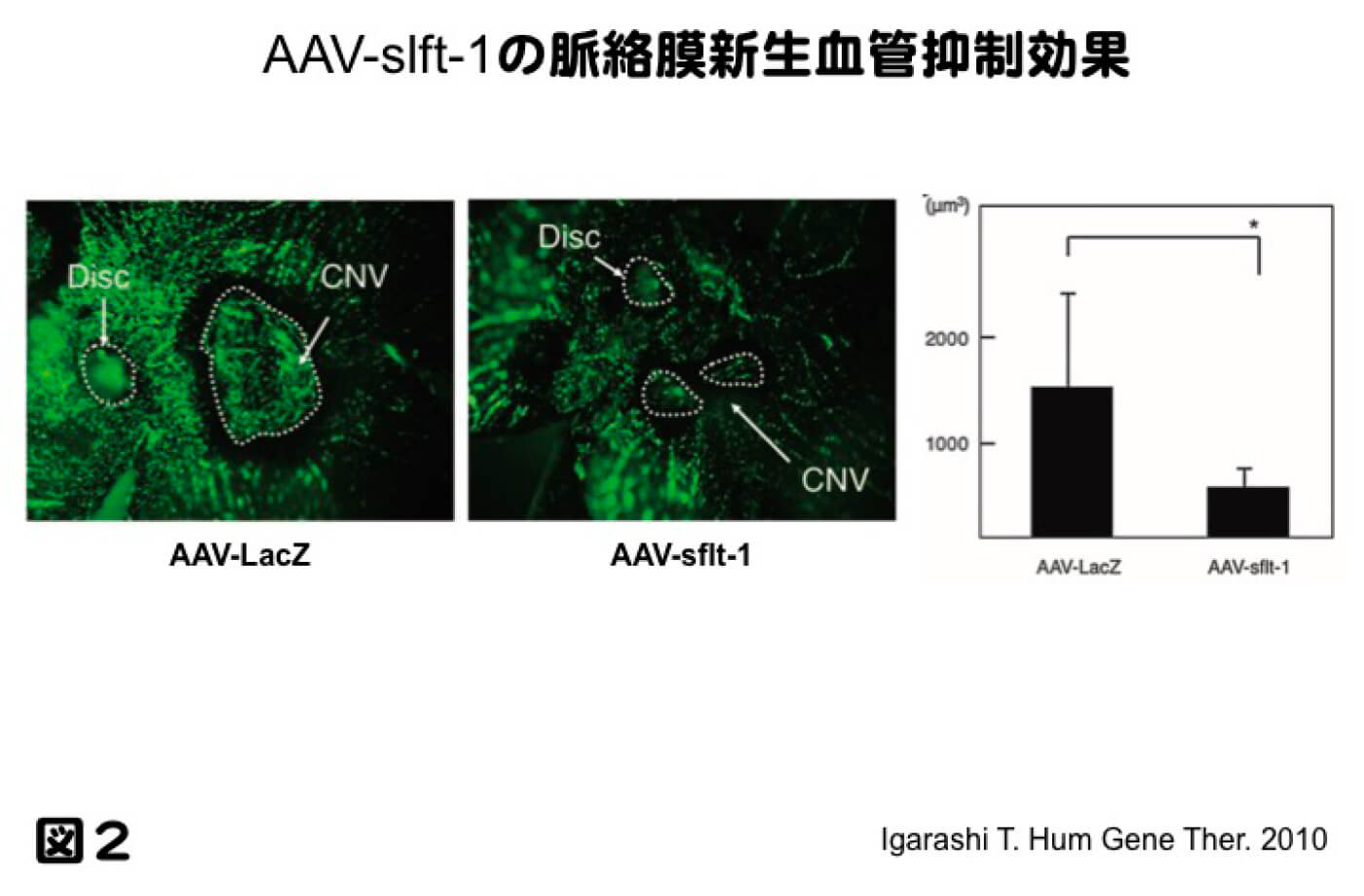
近年AAVにはサブタイプが数多く発見され、現在12種類のサブタイプのAAVベクターが作製されている。その種類により導入しやすい、しにくい組織があることが分かって来た。我々が網膜に導入効率の高いウイルスベクターを選択するため比較実験を行ったところ、網膜下投与でタイプ8の網膜への導入効率が高いということが分かり、加齢黄斑変性モデルに対し、血管内皮成長因子(VEGF)に対する抗体(flt-1)をAAV8ベクターで発現させたところ、非常に効率よく新生血管を抑制した(図2。Igarashi T, et al. Human Gene Therapy. 2010 May;21(5):631-7.)。
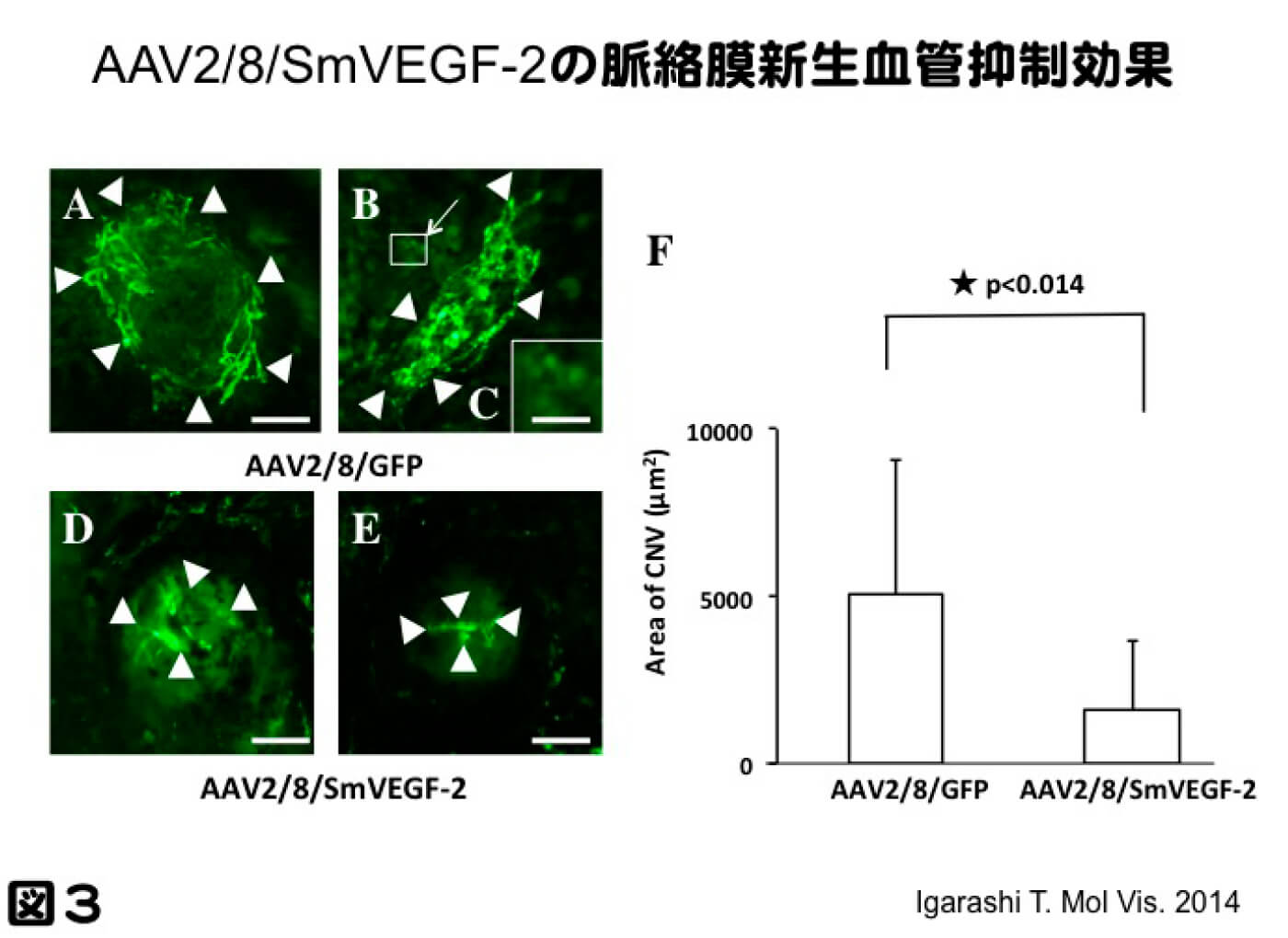
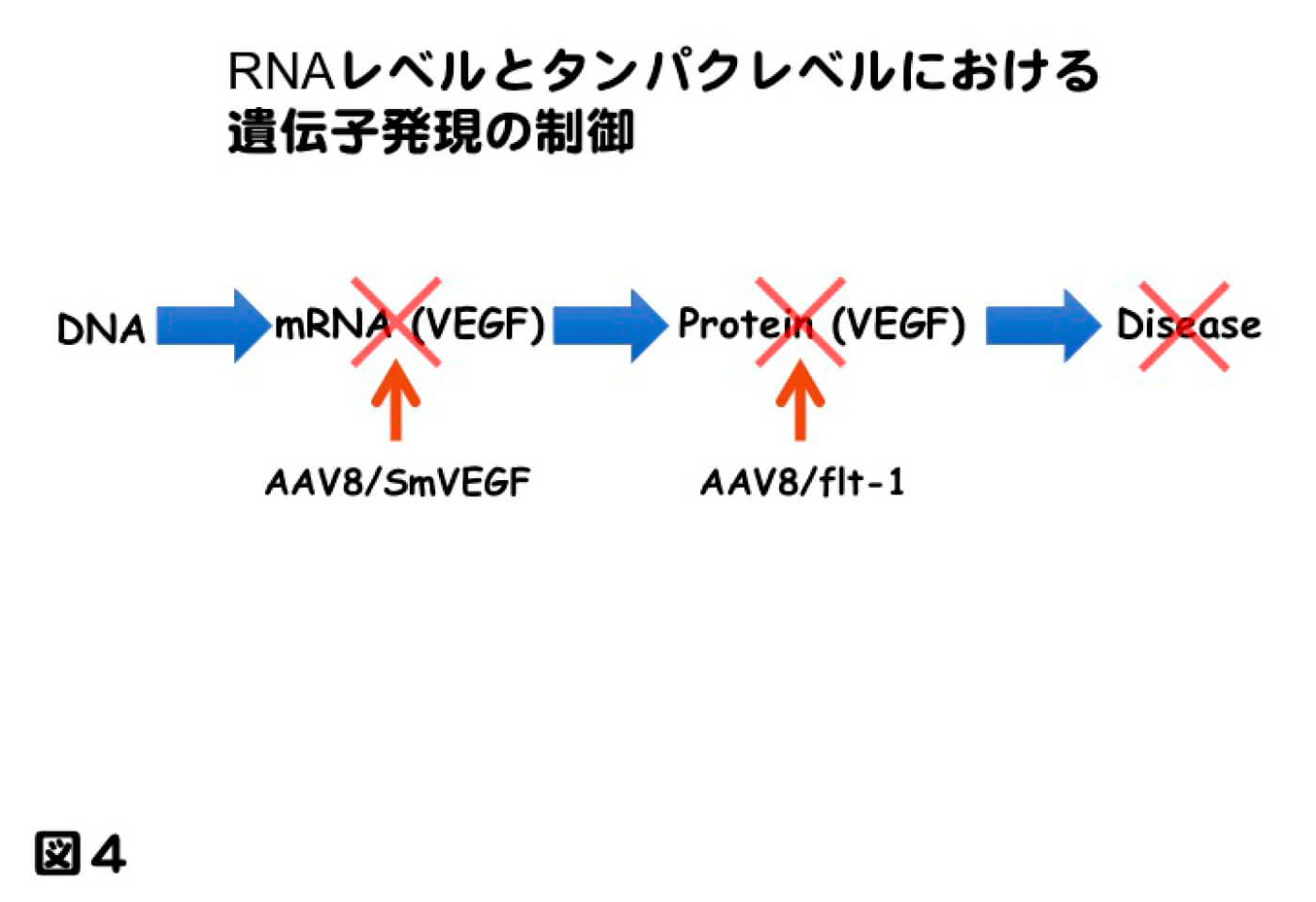
さらにVEGFをより抑制させるため、VEGFをターゲットとしたSiRNAを発現させ、マウスの脈絡膜新生血管モデルに対し、新生血管抑制を検討した。siRNA(small interfering RNA)とは21-23塩基対から成る低分子二本鎖RNAである。 siRNAはRNA干渉(RNAi)と呼ばれる現象に関与しており、mRNAの破壊によって配列特異的に遺伝子の発現を抑制することが可能である。しかしながらsiRNAの配列はどこでもよいというわけではなく、無作為に選択したsiRNAの多くはRNAi効果を示さない。そこでRNAi効果が期待でき、標的遺伝子に対する特異性が高いsiRNAの設計を行い、多種の塩基配列から最も効果的にVEGFを抑制する塩基配列を選択し、それをAAVベクターに組込み発現させ、治療効果について検討した。非常に効率よく、脈絡膜新生血管を抑制した。直接的に比較検討した訳ではないが、抗体であるsflt-1とほぼ同程度の新生血管抑制効果を示すことができた(図3。Igarashi T, et al. Molecular Vision. 2014 20:488-96.)。今後の治療を考える上で、RNAレベル、タンパクレベルでターゲットとなる分子を抑制する新たな治療戦略となり、様々な治療デザインの開発に繋がると考えられる(図4)。
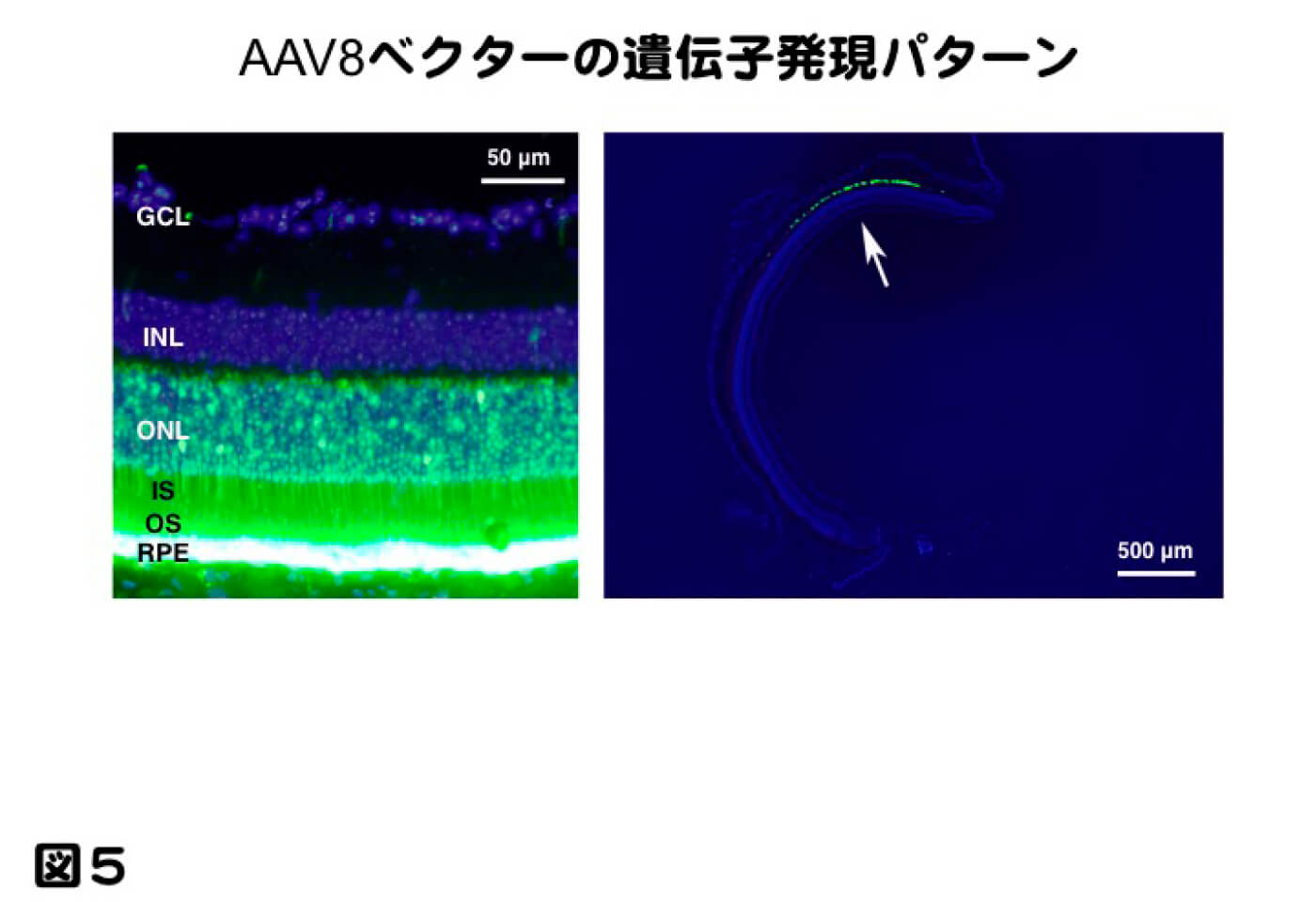
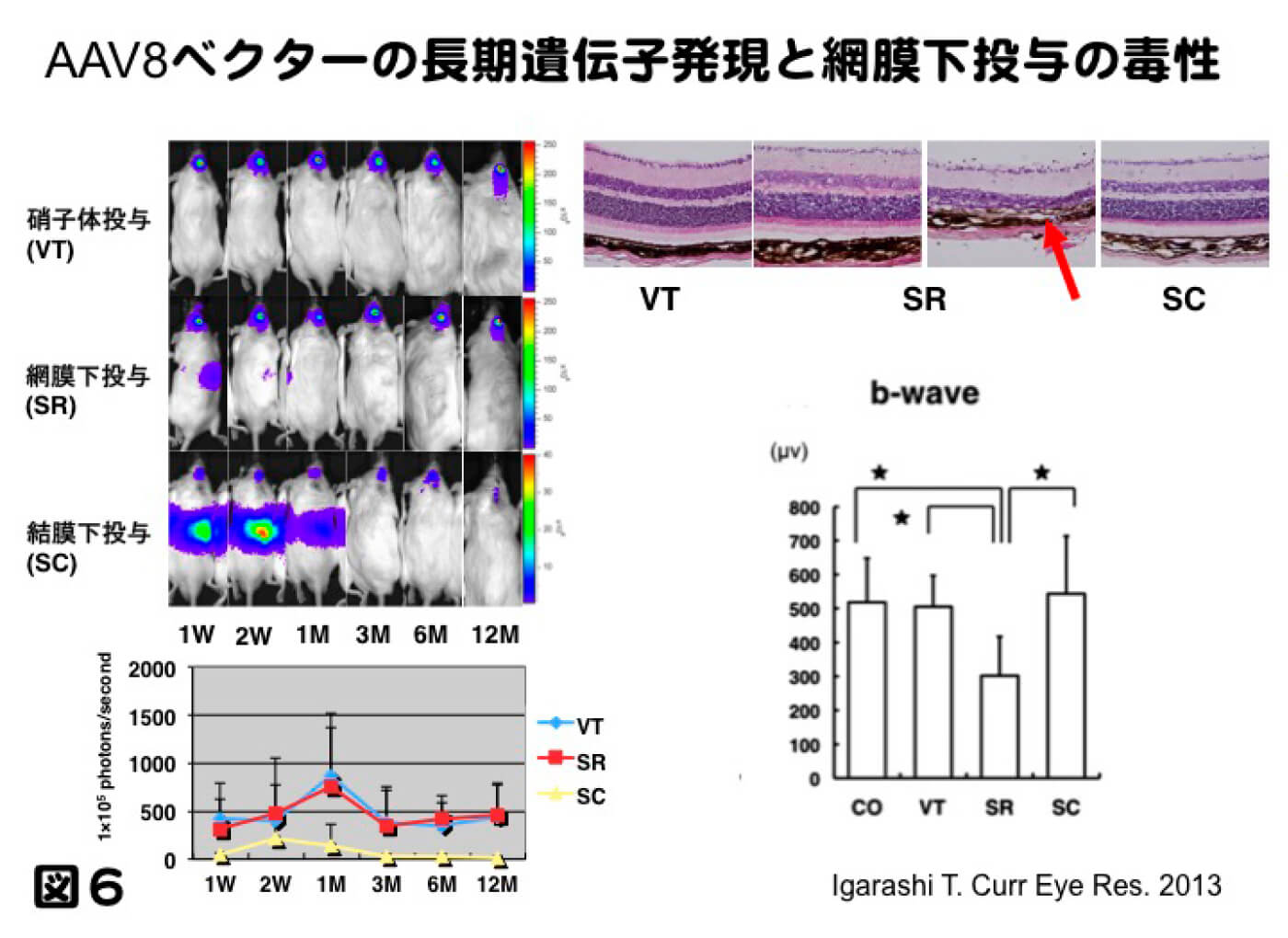
ここまで示してきたのは、網膜下投与による研究結果であるが、網膜への遺伝子治療における投与法を考えると、網膜下投与と硝子体投与の2種類が考えられる。これまで多く研究では、網膜下投与で行われてきた。理由としては、硝子体投与よりも遺伝子導入効率が高く、治療可能な遺伝子発現量を得やすいという特徴があったためである。その半面、網膜下投与では医原性の網膜剥離を作製するため、視機能の低下をもたらし、特に黄斑部の場合、視力低下をもたらすことや、網膜剥離が起きた場所にしか遺伝子導入が生じないというデメリットがある。図5はAAV8ベクターを網膜下投与したものであるが、投与部位に限局して網膜外層である網膜色素上皮細胞および視細胞に遺伝子導入されていることを示している。すなわち、投与されたベクターが接触した組織のみに遺伝子導入されるということになる。我々は、以前ssAAV8ベクターを用い、網膜下投与と硝子体投与における遺伝子発現の比較を1年間かけて行った。遺伝子発現量は投与された部分では圧倒的に網膜下投与の方が高い遺伝子導入効率であったが、眼球全体で比較するとほぼ同等の遺伝子発現量で、硝子体投与では広範囲に弱い遺伝子発現が見られた。しかしながら網膜電図(ERG)で網膜の機能をみると、硝子体投与では網膜機能の低下はみられなかったが、網膜下投与において機能の低下が見られ、病理組織で観察したところ、一部に視細胞の全欠損が見られた(図6。Igarashi T. et al. Current eye research 2013 38(5):569-77.)。レーバー黒内障の臨床試験においても網膜下投与では、黄斑部における網膜厚の低下と何例かの症例で視力低下を認めたと報告された(Jacobson SG. et al. Arch Ophthalmol. 2012; 130: 9-24.)。遺伝子治療の臨床応用では、網膜下投与の場合、ベクターの力価や投与量など慎重に検討する必要があると考えられるし、濃縮方法による挟雑物の排除は極めて重要な課題である。
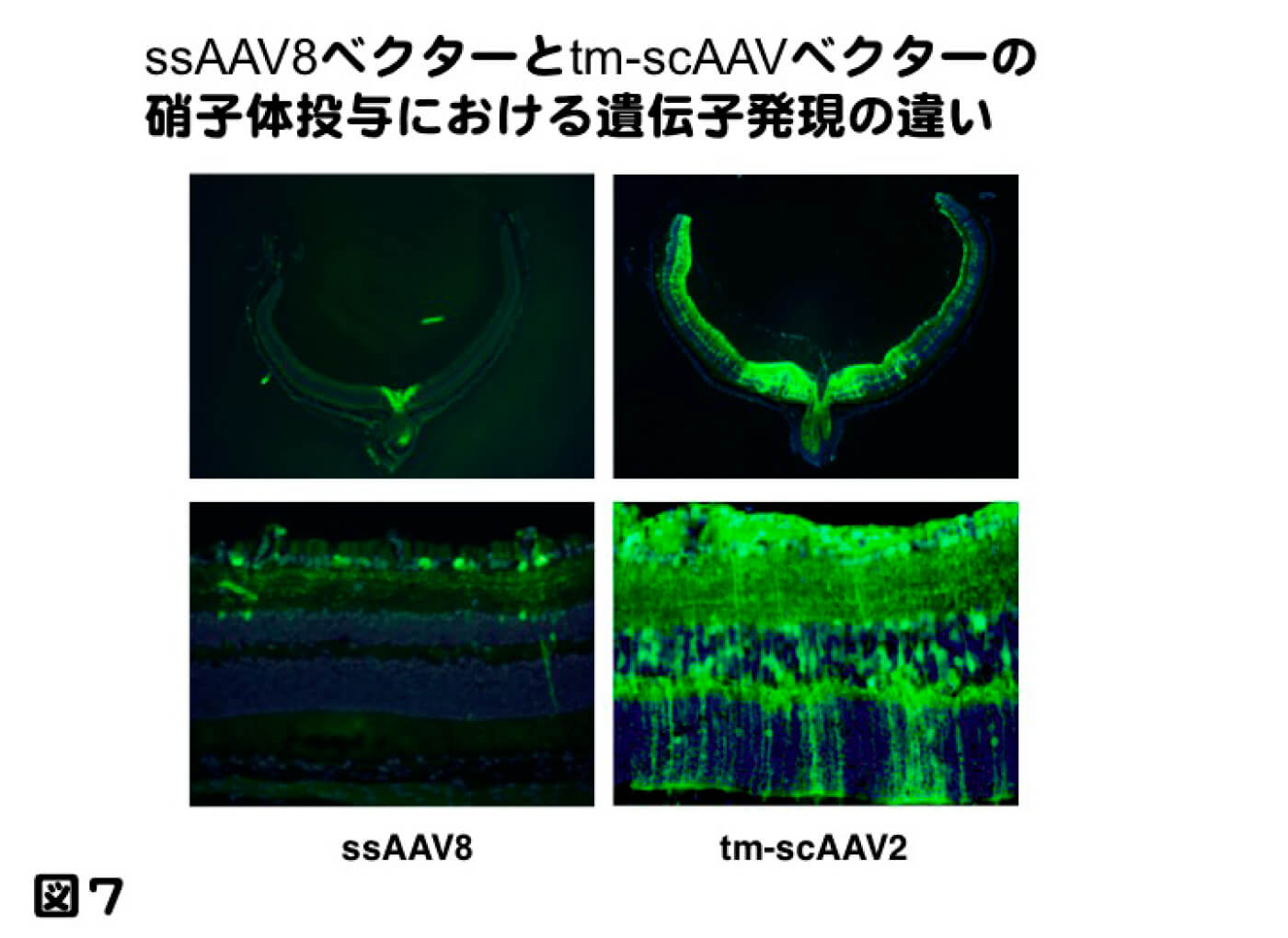
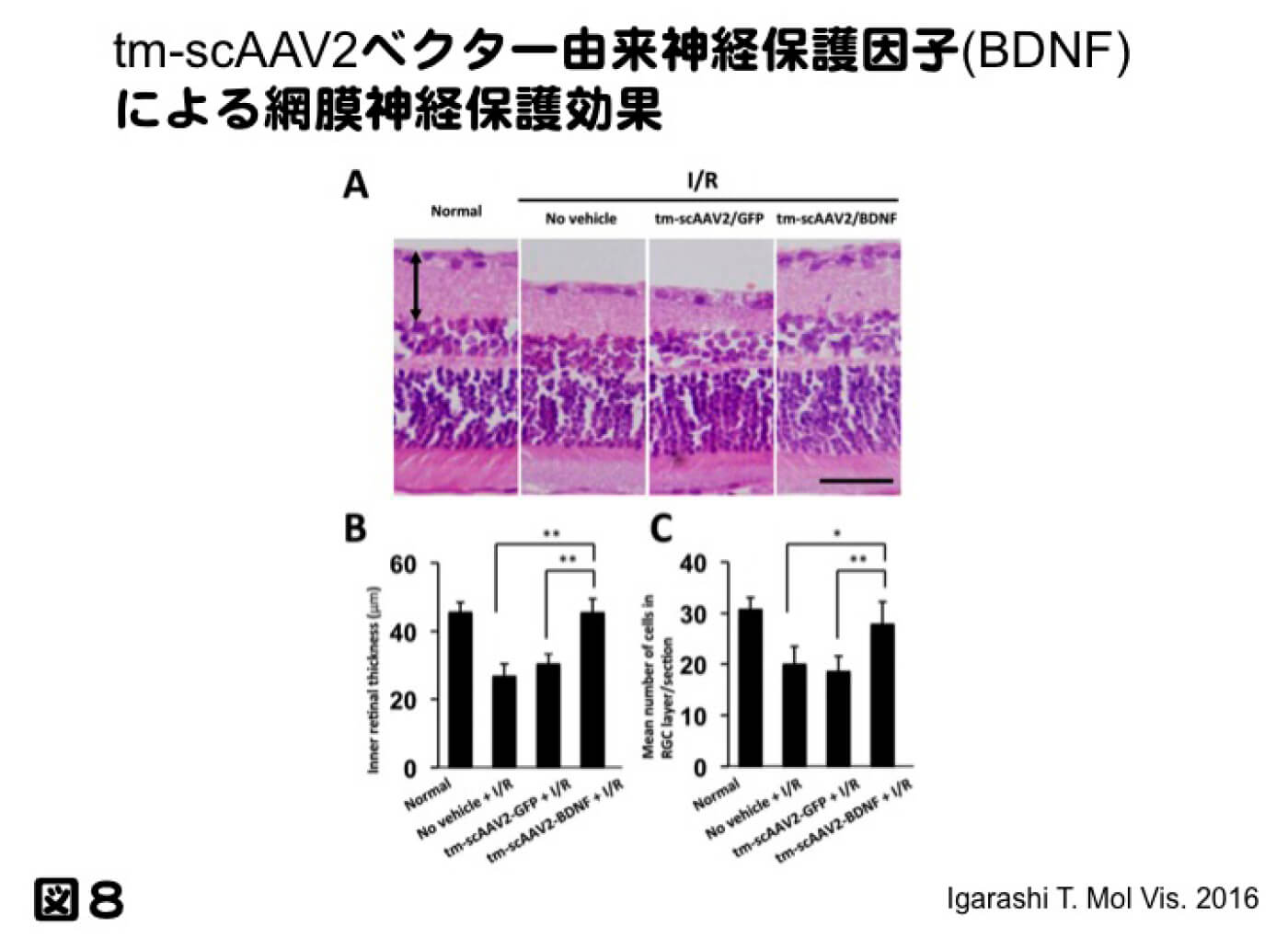
一方、硝子体投与では、中々動物モデルにおいて治療効果を見いだせて来なかった。理由としては、導入した遺伝子発現量が治療効果に達していないと指摘されてきた。近年開発されたウイルスの殻を改変したmutant AAVベクターは、齧歯類に対し、硝子体投与でも高い遺伝子導入効率を得ることが出来るようになった。図7に記すが、これまで硝子体投与で最も高い遺伝子発現を示していたsingle strand (ss) AAV8ベクターに比べ、mutant self complementary (sc) AAV2ベクターは非常に高い遺伝子導入効率が可能となってきた。これを受けて、網膜内層疾患、特に緑内障に対する遺伝子治療が可能になってきたと確信し、緑内障モデルの一つである、一過性高眼圧モデルに対し、神経保護因子であるBDNFをmutant sc AAV2ベクターに組込み遺伝子治療の効果を検討したところ、コントロールとあまり変わらない、非常に高い神経保護効果を得ることが出来た(図8。Igarashi T, et al. Mol Vis. 2016 Jul 16;22:816-26.)。
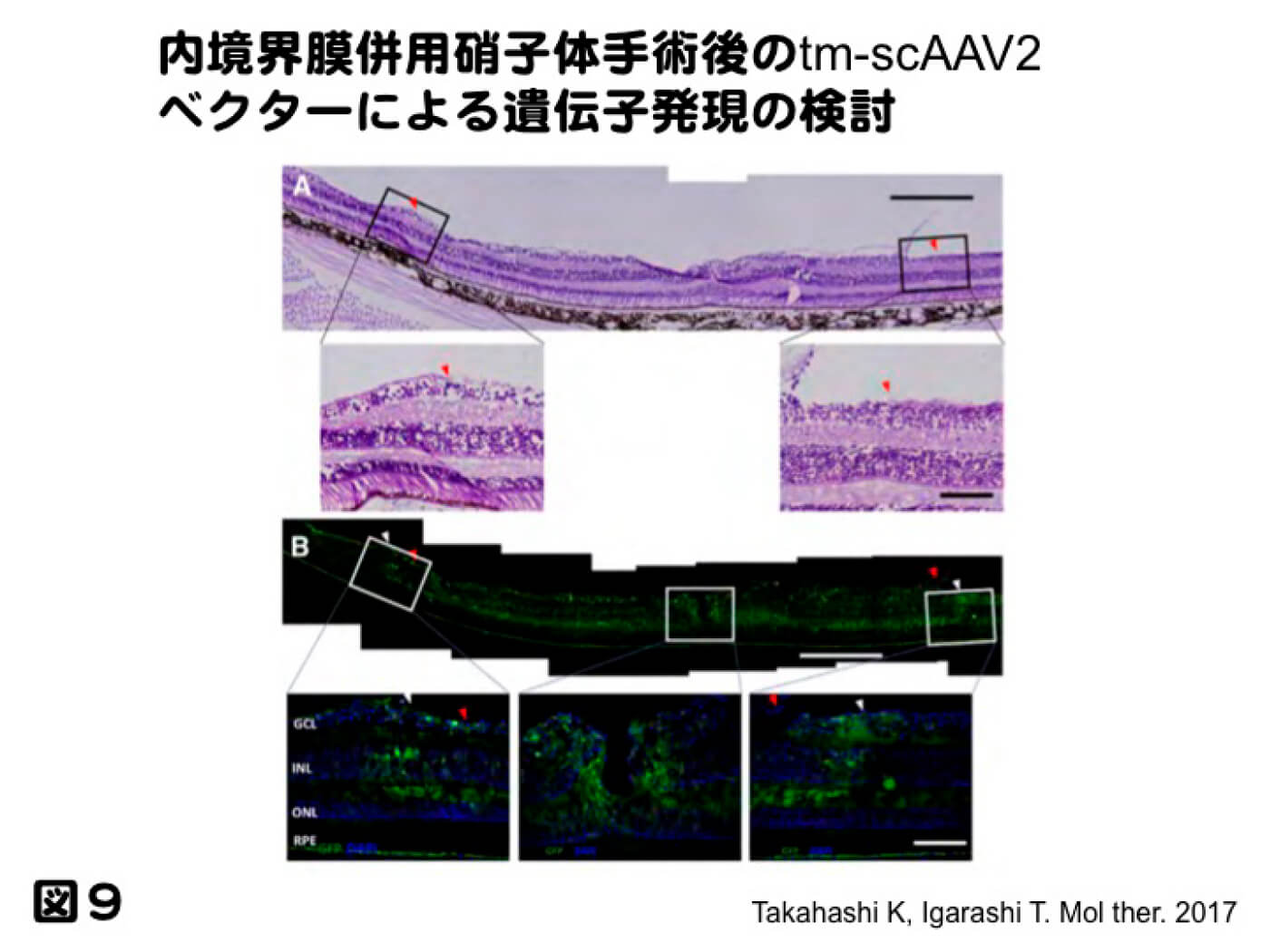
この様にマウスなどの齧歯類に対しては硝子体投与による遺伝子導入により数多くの優れた報告がなされてきている。それに対して、霊長類では黄斑近傍の限られた領域にしか遺伝子導入ができないと報告されてきており、臨床的に考えると非常に大きな問題となっている。我々は、硝子体と網膜の間に介在する内境界膜(Inner limiting membrane; ILM)が障壁となっていると考え、内境界膜併用硝子体手術後にtm-sc AAVベクターを硝子体投与したところ、内境界膜剝離をした群のみで遺伝子導入効率が上昇し、遺伝子導入パターンとしては、内境界膜剝離を行ったところにのみ遺伝子が導入された(図9。Takahashi K, Igarashi T, et al. Mol ther. 2017 Jan 25;1:296-302)。今後、AAVベクターの硝子体投与を考える際、内境界膜併用硝子体手術が必要と言うより、障壁となる内境界膜をどの様に処理していくかが、今後の研究の鍵となると考えられる。これらについては、総説としてまとめてあるので、御一読願いたい(五十嵐勉ら. 眼科分野における遺伝子導入法の開発. 日本医科大学医学会雑誌 13(2) 88-96, 2017)。
現在、AAVタイプ2ベクターによるLeber先天黒内障(LCA)に対する臨床研究が欧米で数多く報告され、米国において2017年12月に、ヨーロッパでは2018年8月に遺伝子治療薬として認可された。コロイデレミア、全色盲、X連鎖性若年性網膜分離症などで臨床応用が進められている。今後、遺伝子治療というアプローチが眼科領域の難治性疾患の標準治療への道を進み始めていると考えられる。しかしながら、遺伝子発現の調節、特異的プロモーターによる制御、CRISPR/Casシステムの応用など、様々な技術の応用についての検討もあり、今後もしっかりとしたAAVベクターにおける基礎的検討がますます重要な鍵となってくると考えられる。
我々も遺伝子治療の実現に向け,新たな技術応用を取り入れ、疾患モデルに対する研究や新規ウイルスベクターの基礎研究を行い、社会還元、医学研究の発展および患者様への貢献を目指して邁進する所存である。
